Rola wapnia w organizmie: poznaj 8 najważniejszych funkcji!
Wapń to najczęściej występujący minerał w naszym organizmie. Pełni rolę budulca dla kości i zębów, uczestniczy w pracy mięśni, serca, neuronów, odporności i regulowaniu ciśnienia tętniczego, a także: steruje cyklem życia komórek i może wywoływać ich planową śmierci (apoptozę). A to tylko jego najważniejsze funkcje!
Z tego artykułu dowiesz się:
Skrót informacji znajdziesz w podsumowaniu.

Sprawdź też: Osteoporoza: przyczyny, objawy, leczenie i profilaktyka.
Co to jest wapń?
Wapń jest piątym najpowszechniejszym pierwiastkiem na Ziemi, trzecim najpowszechniejszym metalem i najpowszechniejszym minerałem w organizmie człowieka. Magazynujemy go w naprawdę dużych ilościach, bo około kilograma. A ponieważ nasze ciało jest niezdolne do produkcji wapnia, minerał ten jest również niezbędnym elementem naszej diety.
Czym jeszcze jest wapń? Przekaźnikiem pierwotnym i wtórnym. Przekaźniki pierwotne to związki służące jednym komórkom – wchodzącym np. w skład tarczycy – do wysyłania informacji drugim komórkom. W ten sposób działa choćby adrenalina, wydzielana przez nadnercza, a trafiająca do serca, co skutkuje zwiększeniem liczby jego uderzeń na minutę.
Przy czym: przekaźniki pierwotne zwykle kończą swoją podróż na powierzchni (błonie) komórki docelowej, gdy aktywują właściwy odbiornik, najczęściej receptor. W odpowiedzi na tę aktywację komórka wydziela przekaźniki wtórne, które modulują pracę jej narządów (organelli). Efektem modulacji może być zaś rozwój komórki, jej proliferacja tudzież namnożenie, planowa śmierć (apoptoza) i tak dalej.
Wreszcie, wapń jest budulcem. Nasze kości i zęby składają się w 1/3 z tkanki żywej, głównie kolagenu, a w 2/3 z minerałów właśnie, przede wszystkim wapnia i fosforu. Ta dwójka łączy się w pary, by następnie – jako mikrokryształy – osiąść na rozpościerających się w kościach, kolagenowych włóknach. Kolagen zapewnia im odporność na rozciąganie, a minerały: na ściskanie. Więcej o kościach (i zębach) na końcu 🙂
Może Cię zainteresować: 12 źródeł wapnia w diecie – od alg po mleko, zapotrzebowanie i suplementacja.
Role wapnia w organizmie
Jako najpowszechniejszy minerał w naszym ciele, wapń ma naprawdę sporo roboty. Do najważniejszych procesów, w których uczestniczy, należą: uwalnianie neuroprzekaźników, koagulacja krwi, regulowanie ciśnienia tętniczego i pracy serca, zwalczanie patogenów, funkcjonowanie i apoptoza komórek, kurczenie mięśni i mineralizacja kości. Każdemu z nich przyjrzymy się w szczegółach!
Wapń w pracy neuronów
Wyjaśnijmy może, tak na dobry początek, czym w ogóle są neurony i jaką rolę pełnią. Otóż: to inaczej komórki nerwowe, odpowiedzialne za przekazywanie informacji między naszymi tkankami – mięśniami, organami – a mózgiem. Informacje, czyli wszystko to, co czujemy (powiew letniej bryzy, klocek Lego pod stopą), robimy (uśmiechanie się), słyszymy (alarm) itd.
By zrozumieć, jak informacje krążą w ciele, i jaką rolę pełni w tym procesie wapń, musimy przyjrzeć się budowie neuronu. A ta jest podobna do budowy drzewa! U podstawy komórki mamy korzenie – fachowo zakończenia aksonu, wyżej znajduje się pień – akson, z kolei szczyt zajmuje korona – dendryty. Co ważne, między dendrytami a aksonem znajduje się jeszcze „mózg” neuronu, czyli jądro w somie.
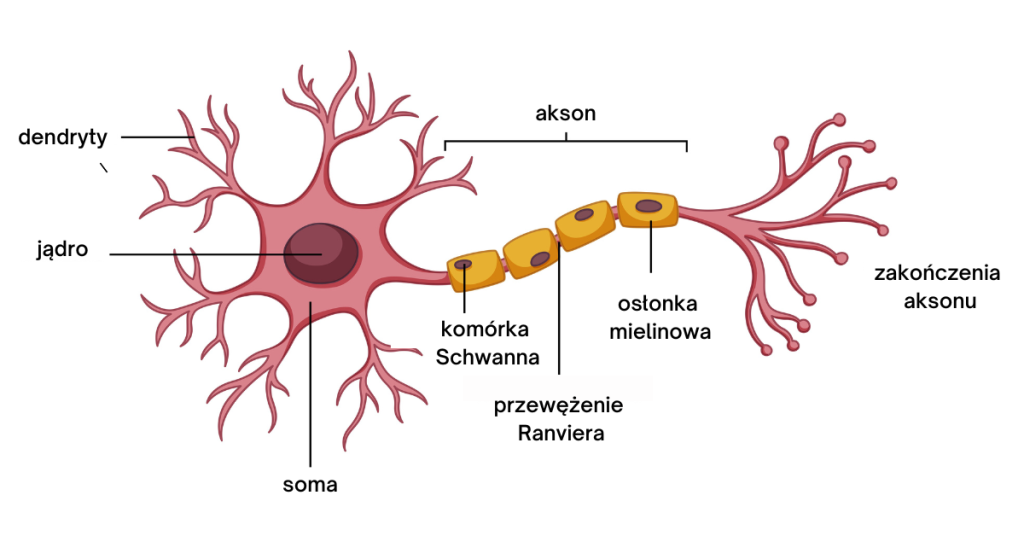
Teraz omówimy funkcje elementów neuronu, a zaczniemy od dendrytów. Ich powierzchnię wypełniają receptory,wrażliwe na konkretne neuroprzekaźniki – np. adrenalinę, serotoninę czy dopaminę. Gdy te substancje przyłączą się do wspomnianych receptorów:
- otworzą się kanały odpowiedzialne za przepuszczanie kationów (atomów o ładunku dodatnim) do środka neuronu, co doprowadzi do wygenerowania impulsu elektrycznego;
albo:
- otworzą się kanały odpowiedzialne za przepuszczanie anionów (atomów o ładunku ujemnym), uniemożliwiając powstanie impulsu i przekazanie go dalej.
My przyjrzymy się scenariuszowi a), bo jednym z czterech najważniejszych kationów jest… wapń. Gdy przenika on do neuronów, powiększa się nierównowaga między liczbą dodatnio naładowanych atomów na zewnątrz i wewnątrz komórki. Neuron zyskuje niższy ładunek od otoczenia.
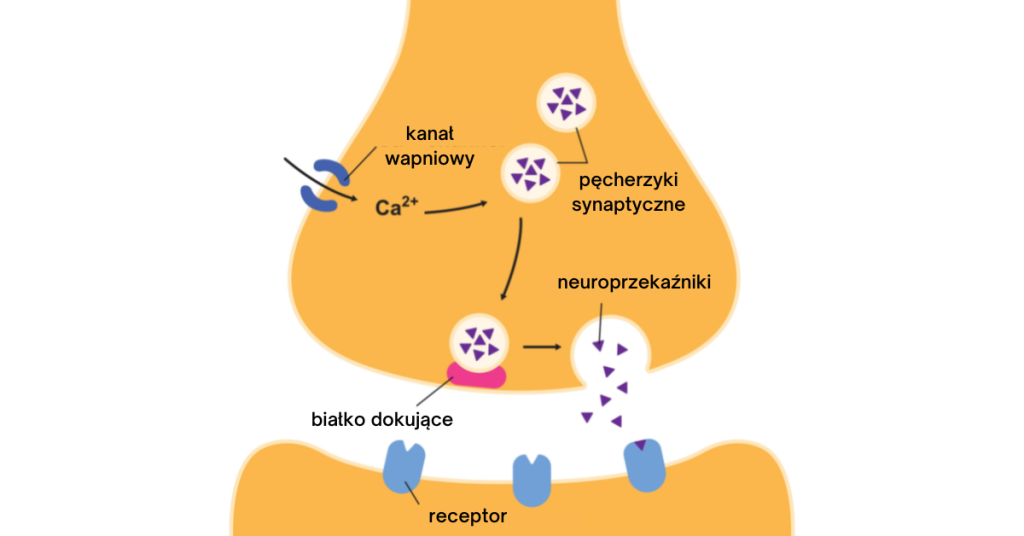
O ile ta różnica osiągnie wartość co najmniej 15 miliwolt (-55 mv) względem otoczenia (-70 mv), informacja powędruje do jądra w somie. Stamtąd impuls biegnie przez akson, aż do zakończeń aksonów, co skutkuje wpuszczeniem wapnia do wnętrza komórki na końcu nerwu. Efekt? Kiedy wapń wchodzi, neuroprzekaźniki wychodzą, trafiając do kolejnych neuronów. I tak w kółko.
Podsumowując: wapń to jeden z ważniejszych (obok potasu, chloru i sodu) kationów wykorzystywanych przez neurony do przekazywania informacji. Służy im zarówno do generowania ładunku elektrycznego, jak i do uwalniania neuroprzekaźników. Jego rola w układzie nerwowym jest więc kluczowa – tym istotniejsza, jeśli brać pod uwagę fakt, że przeciętny mózg składa się z ponad 86 miliardów neuronów.

Wapń w krzepnięciu (koagulacji) krwi
Gdy naczynie krwionośnie ulega uszkodzeniu, ciało musi powstrzymać utratę krwi. Rozwiązanie wydaje się oczywiste: odtworzenie zniszczonych tkanek.Ale ten proces trwa – godziny, dni, czasem tygodnie – dlatego potrzebujemy błyskawicznego, a zarazem tymczasowego sposobu na zatamowanie krwawienia. I właśnie taką rolę pełnią zakrzepy krwi, powstające przy udziale wapnia.
Po kolei. We krwi człowieka krąży specjalna glikoproteina (połączenie cukru, gliko, z białkiem, proteiną), zwana Czynnikiem von Willebranda. Jej zadanie? Wiązanie się z włóknami kolagenowymi, odsłanianymi wskutek uszkodzenia, a następnie ściąganie na miejsce inne białka – płytek krwi. Przyłączają się one bądź do kolagenu, bądź do czynnika, uwalniając przy okazji ponad 300 różnych substancji.
Jedną z nich jest wapń, wydzielany w większości przez płytki krwi wiążące się z kolagenem. Minerał ten pełni wówczas rolę przekaźnika pierwotnego, bo sygnalizuje innym płytkom z krwioobiegu konieczność przyłączenia się do formowanego zakrzepu. Ponadto, do zadań wapnia należy także aktywacja czynnika koagulacyjnego FXIII, powstrzymującego ciało przed zbyt wczesnym usunięciem zakrzepu.
A skąd ta rzymska liczba na końcu? Proces krzepnięcia krwi nazywamy fachowo kaskadą koagulacyjną – „kaskadą”, bo przebiega on etapowo – w której uczestniczy co najmniej 20 różnych białek, receptorów, minerałów itd. Oznaczamy je liczbami (od I do XX) z przedrostkiem F (z ang. Factor, czyli czynnik). W tym systemie wapń występuje pod nazwą FIV, choć na wykresach bywa również oznaczany jako CA2+.

Wapń a ciśnienie tętnicze krwi
Tętnice to największe naczynia krwionośne, niosące krew z i do serca oraz z i do płuc. Otaczają je mięśnie, odpowiedzialne za regulację ciśnienia krwi. Gdy się kurczą: średnica tętnic ulega zmniejszeniu, co skutkuje wzrostem ciśnienia, a gdy się rozszerzają – światło tętnic ulega rozszerzeniu, zatem ciśnienie spada.
Mięśnie, podobnie jak inne tkanki naszego ciała, składają się z komórek, a komórki te wypełnia specjalny płyn, cytozol. Czym zaś większe stężenie wapnia w cytozolu, tym wrażliwsze stają się komórki na sygnały o konieczności rozluźnienia lub skurczenia mięśni. Minerał ten zwiększa także opór obwodowy naczyń, czyli, w ogromnym uproszczeniu, „usztywnia” naczynia, podnosząc ciśnienie krwi.
Czy to źle? Niekoniecznie. Jeśli znasz kogoś o zbyt niskim naturalnym ciśnieniu krwi, wiesz, że ono też może uprzykrzać życie – w równym stopniu, co nadciśnienie. O ile więc jesteśmy w pełni zdrowi, wapń umożliwia nam zachowanie ciśnienia optymalnego, potrzebnego do funkcjonowania na co dzień. Z założenia jest więc dobry (choć zbyt wielka koncentracja wapnia w cytozolu również może być szkodliwa!).
Wracając zaś do tematu… oprócz mięśni gładkich otaczających tętnice, wapń wpływa też na hormony, a mianowicie: reninę, angiotensynę i aldosteron. Układ ten – w skrócie RAAS – aktywuje się w odpowiedzi na spadającą objętość krwi i/lub brak dostatecznej ilości sodu w obiegu, np. wskutek odwodnienia. Jego rolą jest przywrócenie, względnie podniesienie ciśnienia tętniczego krwi do prawidłowego poziomu.
RAAS osiąga ten cel poprzez: zwężenie światła tętnic (by zatrzymać spadek ciśnienia), ograniczenie ilości wody wydalanej z organizmu i wysycanie nią krwi, oraz uwolnienie sodu do krwioobiegu. A jako że wapń – w optymalnych ilościach – ogranicza syntezę wymienionych hormonów, to zapobiega zwiększaniu ciśnienia krwi ponad miarę. Optymalnych ilościach, czyli takich zapewnianych przez przeciętną, europejską dietę.
Wapń w pracy serca
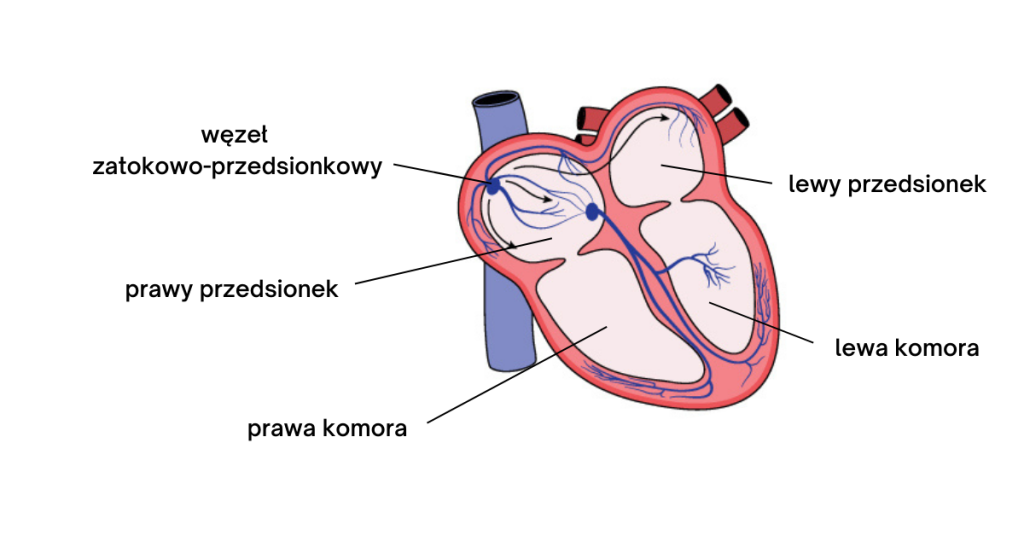
Serce dzielimy na pięć podstawowych elementów: przedsionek lewy i komorę lewą, przedsionek prawy i komorę prawą, oraz węzeł zatokowo przedsionkowy. Jego lewa strona – przedsionek i komora – zajmują się pompowaniem krwi zużytej, pozbawionej tlenu, z ciała do płuc. Jego prawa strona – znów, przedsionek i komora – przekazują świeżo natlenioną krew z płuc do ciała.
W węźle zatokowo-przedsionkowym powstają natomiast sygnały elektryczne, które zarządzają pracą obu komór, tj. prawej i lewej. Gdy sygnał przechodzi przez mięsień sercowy, sprawia, że komory się kurczą, wyrzucając krew do tętnic, zaś po przejściu sygnału – rozkurczają, wpuszczając do pustych komór krew z przedsionków. Cykl ten nazywamy cyklem sercowym, a wapń odgrywa w nim kluczową rolę.
Jaką? Otóż najmniejszą jednostką, komórką, które tworzą mięsień sercowy, jest kardiomiocyt, a pośrodku tej komórki pływa „magazyn” wapnia – retikulum sarkoplazmatyczne, w skrócie SR. I tak się składa, że w chwili dotarcia impulsu elektrycznego z węzła zatokowo-przedsionkowego do kardiomiocytu, SR wyrzuca duże ilości wapnia do cytozolu (przypomnijmy: płynu wypełniającego wnętrze komórek).
W efekcie, ładunek elektryczny komórki ulega zmianie z pozytywny na negatywny. Impuls przekazywany jest do kolejnych kardiomiocytów, ale co jeszcze ważniejsze: wyrzucony wapń łączy się ze specjalnym białkiem,troponiną, co prowadzi do skurczenia się mięśnia sercowego. Następnie wapń odłącza się od troponiny i wraca do SR, a serce na powrót się rozluźnia, wpuszczając nową krew do komór.
Wapń może też wydostawać się poza kardiomiocyty i do nich wracać – zależnie od tego, w jakich ilościach go potrzebujemy. Dla przykładu: to właśnie ilość jonów wapnia dostępnego w cytozolu kardiomiocytu determinuje moc, z jaką serce uderzy. Albo: populacja wapnia może regulować ilość sodu oraz potasu w kardiomiocytach (o roli tych elektrolitów w sercu napiszemy jednak innym razem).

Wapń a odporność
Limfocyty typu T to rodzina komórek wchodząca w skład naszego układu odpornościowego. Ich rola? To zależy – od rodzaju limfocytu. Istnieją limfocyty T dziewicze, których zadaniem jest 1) wykrycie oraz 2) zapamiętanie intruzów, z którymi jeszcze nie walczyliśmy. Albo: limfocyty T cytotoksyczne, wpuszczająca cytotoksyny do zainfekowanej komórki celem jej uśmiercenia… i tak dalej.
Wykrywanie i zapamiętywanie intruzów realizowane jest przy użyciu antygenów. To białka umieszczane przez organizm na powierzchni wrogich obiektów (wirusów, bakterii), a wykrywane przez limfocyty T – za pomocą specjalnego receptora. Gdy antygen wiąże się z receptorem, dochodzi do opróżnienia magazynu wapnia komórki, retikulum endoplazmatycznego, a minerał trafia do cytoplazmy.
Równolegle limfocyty produkują gliceryd, diacyloglicerol, aktywujący enzym, kinazę proteinową C. Ten, ostatni, wspólnie z wapniem, prowadzą do przemodelowania cytoszkieletu (wewnętrznego szkieletu – komórki też go mają!). Efekty? Po pierwsze: limfocyty stają się bardziej mobilne. Po drugie: wykształcają synapsę immunologiczną, która pozwala im komunikować się z rozpoznanym antygenem.
Diacyloglicerol, dodajmy, pełni jeszcze jedną istotną funkcję. Do jego zadań należy bowiem sprowadzanie wapnia spoza komórki, co skutkuje aktywacją czynników transkrypcyjnych (m.in. AP-1 i NFAT). Jak sama nazwa wskazuje, są niezbędne do procesu transkrypcji, w którym fragment DNA – np. instrukcja produkcji konkretnego białka – jest przekładany na RNA. Tak przełożone informacje sterują pracą komórki.
Rola wapnia nie ogranicza się jednak do limfocytów. Wyrzut wapnia z retikulum endoplazmatycznego do cytoplazmy zachodzi bowiem m.in. w mastocytach. Efekt? Komórki te uwalniają do otoczenia substancje pośredniczące w rozwoju stany zapalnego. Co więcej, wapń uczestniczy też w produkcji cytokin, chemokin i… wciąż odkrywamy nowe, pełnione przez niego zadania.
Wapń w pracy i apoptozie komórek
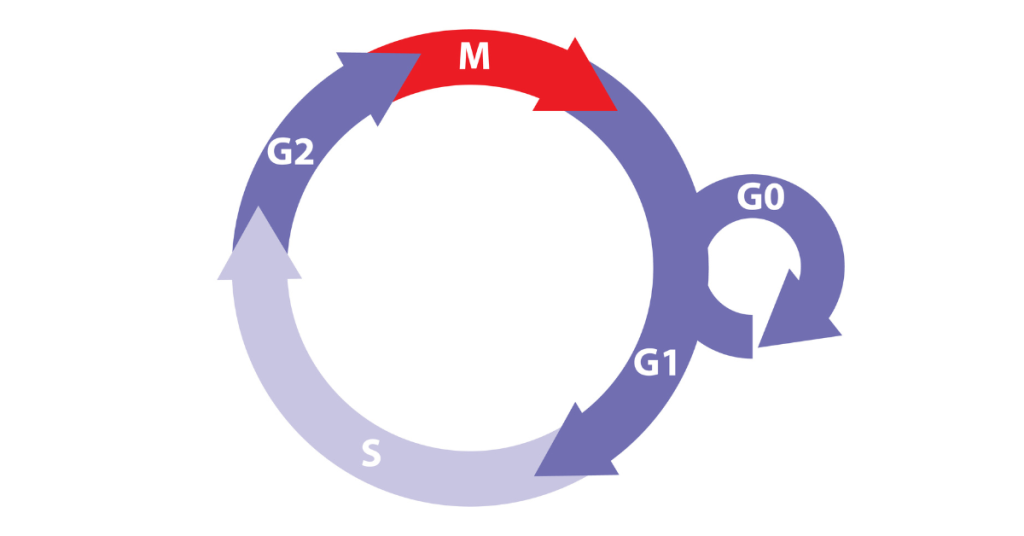
Większość komórek naszego ciała pracuje w dobowych cyklach: godzinę poświęca na rozmnażanie przez podział, fachowo mitozę, a pozostałe 23 godziny na rozwój, fachowo interfazę. Samą interfazę dzielimy na trzy etapy, mianowicie G1 (Gap-1, z ang. Przerwa-1), S (Synthesis, z ang. Synteza) oraz G2 (Gap-2, z ang. Przerwa-2). A jako przekaźnik wtórny, wapń jest zaangażowany na każdym z tych etapów.
Pierwszy etap, Gap-1, następuje świeżo po zakończonym podziale. W jego trakcie komórka jest skupiona na wzroście, a więc rozwoju organelli, zwiększaniu populacji enzymów, białek etc. Jedenaście godzin później dociera zaś do punktu kontrolnego, gdy musi zdecydować, czy chce się podzielić – i dążyć do tego celu za wszelką cenę – czy zatrzymać się w „trybie czuwania”, G0.
Jeśli zapadnie decyzja o przejściu do następnej fazy, Synthesis,musi dojść do gwałtownego wzrostu ilości kalmoduliny – białka modulowanego przez wapń (Calcium-modulated protein, w skrócie Calmoduline) – w cytoplazmie komórki. Na ilości kalmoduliny, aktywnej tylko po związaniu się z jonami wapnia, polega kluczowy enzym: CaMKII. Badania sugerują, że przejście z fazy G1 do S jest bez niego niemożliwe.
Co więcej, wapń jest także potrzebny do odblokowania – fachowo fosforylacji – retinoblastomy, białka będącego zarazem czynnikiem transkrypcyjnym. Pisaliśmy o nich wcześniej. W każdym razie: czynnik ten uczestniczy w ekspresji genów niezbędnych do startu fazy S! A co jeszcze ciekawsze, stężenie wapnia w otoczeniu komórki determinuje tempo powielania DNA, realizowanego właśnie w fazie S.
Mniej więcej po ośmiu godzinach, gdy materiał genetyczny komórki zostanie podwojony, ta przechodzi do etapu Gap-2 – ponownie skupiając się na wzroście. Gdy miną kolejne cztery godziny, przychodzi czas na ostatnią fazę cyklu komórkowego: mejozę (lub mitozę – zależnie od rodzaju komórki). I tu powtarza się historia z kinazą białkową II zależną od kalmoduliny, CaMKII: bez niej rozpocząć podziału się nie da.
A gdzie cykl komórkowy się kończy? Otóż wraz z jej apoptozą, czyli planowaną śmiercią. Komórka może zrealizować samozagładę na szereg sposobów, a jednym z nich jest zaburzenie równowagi wapniowej w jej wnętrzu. Jest to możliwe np. wskutek wyrzucenia wapnia z retikulum (sarko- lub endoplazmatycznego) do wnętrza komórki – i ściągnięcia go z zewnątrz – w takiej jego ilości, by stał się toksyczny.
Wapń a praca (skurcze) mięśni
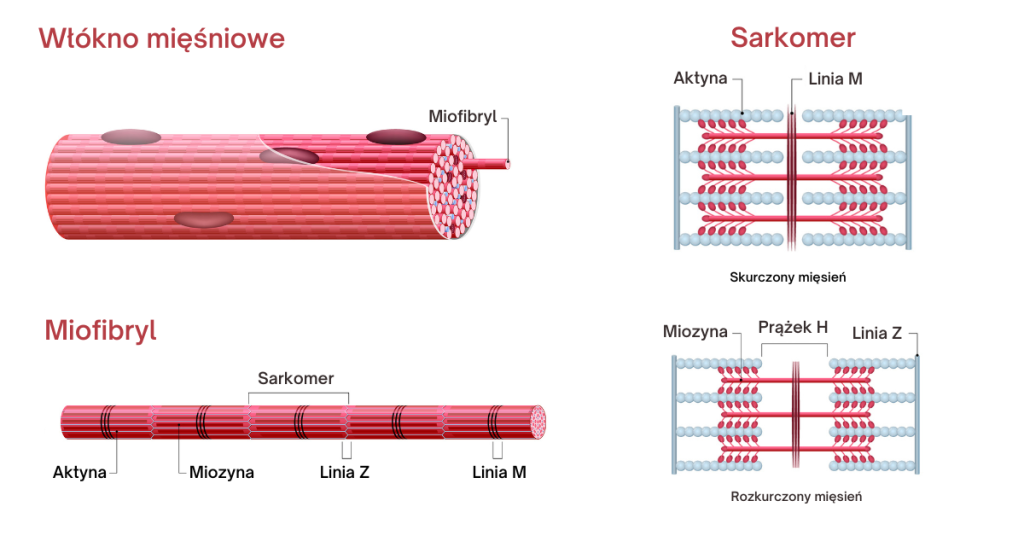
Nasze mięśnie składają się z pęczków włókien mięśniowych, pęczki z włókien, włókna z miofibryli, miofibryle z sarkomerów, a sarkomery – z ułożonych naprzemiennie białek, aktyny i miozyny. Otacza je, opisywany przez nas wyżej, magazyn wapnia, czyli retikulum sarkoplazmatyczne (SR), wraz z organellami: jądrami, mitochondriami, aparaty Golgiego etc. Pracą sarkomerów sterują zaś, przylegające do włókien, neurony motoryczne.
A jak przebiega proces kurczenia mięśni? Najpierw neuron motoryczny uwalnia neuroprzekaźniki, między innymi acetylocholinę, aktywujące receptory na powierzchni włókien mięśniowych. W konsekwencji, do wnętrza włókien wpuszczane są jony sodu i potasu – oba o dodatnim ładunku elektrycznym. To skutkuje zmianą ładunku wewnątrz włókna, co prowadzi do uwolnienia wapnia z SR.
Teraz do akacji wkraczają aktyna z miozyną: to dłuuugie białka, ułożone naprzemiennie (aktyna-miozyna-aktyna-miozyna…), wzdłuż siebie. Na powierzchni miozyny znajdują się drobne, odstające na boki rączki – fachowo filamenty – które mogą przyciągać aktynę. W stanie spoczynku, gdy stężenie wapnia jest małe, rączki przylegają do miozyny; zaś gdy to stężenie rośnie, rączki unoszą się, chwytając aktynę.
Filamenty miozyny chwytają aktynę, przyciągają ją do siebie – zmieniając po drodze własną strukturę molekularną – a następnie puszczają. Cały proces powtarza się do momentu, w którym aktyna nasunie się na miozynę, co skutkuje skróceniem długości całego sarkomeru. I to właśnie do skracania pojedynczych sarkomerów sprowadza się kurczenie mięśni!
Na marginesie: powyżej opisaliśmy udział wapnia w pracy mięśni poprzecznie prążkowanych. Między nimi – tj. sercem, mięśniami szkieletowymi – a mięśniami gładkimi występuje trochę różnic, ale co do zasady, wapń umożliwia „chwytanie” aktyn przez filamenty miozyn.
Wapń w budowie kości i zębów
Wbrew pozorom, nasze kości nie są ledwie „martwą materią”: to żywa tkanka, remodelowana – tudzież rozbierana i budowana – bez chwili wytchnienia. W ich wnętrzu biegną naczynia krwionośne, mieści się szpik kostny, a także rezerwuar minerałów, przede wszystkim fosforu i wapnia. Ba! Kości magazynują przeszło 99% (ok. 990 gram) wapnia, a ciało na bieżące potrzeby wykorzystuje tylko…1% ( 10 gram).
Strukturyzowaniem wnętrza kości zajmują się osteoblasty. Wydzielają one między innymi kolagen typu I, białka niekolagenowe – osteonektyny, osteopontyny – i proteoglikany, a wszystkie te elementy tworzą organiczną macierz kostną. Macierz poddawana jest zaś mineralizacji, polegającej na łączeniu się fosforu i wapnia w mikrokryształy, a następnie osiadaniu kryształów na kolagenowych włóknach.
Ilość odłożonych w ten sposób minerałów determinuje gęstość mineralną kości. (W skrócie BMD, z ang. Bone Mineral Density). Co do zasady: im wyższa gęstość, tym wyższa wytrzymałość mechaniczna kości, a więc i niższe prawdopodobieństwo złamania. A także: większe zapasy, bo kości, jak już wspominaliśmy, są wielkim magazynem wapnia, opróżnianym, gdy tego brakuje w naszej diecie.
Minerał ten pełni równie istotną rolę w zębach, a raczej w szkliwie. Badania wskazują bowiem, że wapń jest głównym budulcem szkliwa, tworzącym – z niewielkim udziałem magnezu – ponad 87% jego objętości i 95% wagi(!). A im głębsze warstwy badamy, tym silniejsza ich mineralizacja. Nic dziwnego, jeśli weźmiemy pod uwagę, że to właśnie minerały stanowią o wytrzymałości szkliwa.
Podsumowanie
Od generowania impulsów elektrycznych w neuronach przez degranulację płytek krwi, łączenie miozyny z aktyną, proliferację i apoptozę komórek, sterowanie pracą limfocytów, aż po wytrzymałość mechaniczną kości czy regulację ciśnienia krwi… Trudno znaleźć minerał, który byłby równie szeroko wykorzystywany przez nasz organizm – i równie intensywnie przezeń magazynowany.
- Espinoza-Fonseca L. M.: The Ca2+-ATPase facilitates bidirectional proton transport across the sarco/endoplasmic reticulum [dostęp: 25.07.2022].
- Khazai N., Judd S. E., Tangpricha V.: Calcium and Vitamin D: Skeletal and Extraskeletal Health [dostęp: 25.07.2022].
- Peacock M.: Calcium Metabolism in Health and Disease [dostęp: 25.07.2022].
- Südhof T. C.: Calcium Control of Neurotransmitter Release [dostęp: 25.07.2022].
- Hands J. M., Moy L. S.: Calcium: More Than Bone? Implications for Clinical Practice and Theory [dostęp: 25.07.2022].
- Shaker J. L., Deftos L.: Calcium and Phosphate Homeostasis [dostep: 25.07.2022].
- Drake T. M., Gupta V.: Calcium [dostęp: 25.07.2022].
- Zaloga G. P., Strickland R. A., Butterworth J. F., Mark L. J., Mills S. A., Lake C. R.: Calcium attenuates epinephrine’s beta-adrenergic effects in postoperative heart surgery patients [dostęp: 25.07.2022].
- Stewart T. A., Felicity M. D.: An element for development: Calcium signaling in mammalian reproduction and development [dostęp: 25.07.2022].
- Pu F., Chen N., Xue S.: Calcium intake, calcium homeostasis and health [dostęp: 25.07.2022].
- Raffaello A., Mammucari C., Gherardi G., Rizzuto R.: Calcium at the Center of Cell Signaling: Interplay between Endoplasmic Reticulum, Mitochondria, and Lysosomes [dostęp: 25.07.2022].
- Duchen M. R.: Mitochondria and calcium: from cell signalling to cell death [dostęp: 25.07.2022].
- Barańska J.: Wapń jako pierwotny i wtórny przekaźnik informacji. Udział Ca2+ w cyklu komórkowym, sekrecji i adhezji [dostęp: 25.07.2022].
- Theivendren P., Kunjiappan S., Hegde Y. M., Vellaichamy S., Gopal M., Dhramalingam S. R., Kumar S.: Importance of Protein Kinase and Its Inhibitor: A Review [dostęp: 25.07.2022].
- Fabbro D., Cowan-Jacob S. W., Moebtiz H.: Ten things you should know about protein kinases: IUPHAR Review 14 [dostęp: 25.07.2022].
- Rahamimoff R., Lev-Tov A., Meiri H.: Primary and Secondary Regulation of Quantal Transmitter Release: Calcium and Sodium [dostęp: 25.07.2022].
- Smajilovic S., Tfelt-Hansen J.: Calcium acts as a first messenger through the calcium-sensing receptor in the cardiovascular system [dostęp: 25.07.2022].
- Tai V., Leung W., Grey A., Reid I. R., Bolland M. J.: Calcium intake and bone mineral density: systematic review and meta-analysis [dostęp: 25.07.2022].
- Vannucci L., Fossi C., Quattrini S., Guasti L., Pampaloni B., Gronchi G., Giusti F., Romagnoli C., Cianferotti L., Marcucci G., Brandi M. L.: Calcium Intake in Bone Health: A Focus on Calcium-Rich Mineral Waters [dostęp: 25.07.2022].
- Murshed M.: Mechanism of Bone Mineralization [dostęp: 25.07.2022].
- Michigami T.: Skeletal mineralization: mechanisms and diseases [dostęp: 25.07.2022].
- Golub E. E.: Role of Matrix Vesicles in Biomineralization [dostęp: 25.07.2022].
- Clarke B.: Normal Bone Anatomy and Physiology [dostęp: 25.07.2022].
- Thomson B. M.: Bone, Encyclopedia of Human Nutrition (Second Edition) [dostęp: 25.07.2022].
- Ludwig P. E., Reddy V., Varacallo M.: Neuroanatomy, Neurons [dostęp: 25.07.2022].
- Raine C. S.: Characteristics of the Neuron, Basic Neurochemistry: Molecular, Cellular and Medical Aspects, 6th edition [dostęp: 25.07.2022].
- Alcohol Health and Research World: The Principles of Nerve Cell Communication [dostęp: 25.07.2022].
- Herculano-Houzel S.: The Human Brain in Numbers: A Linearly Scaled-up Primate Brain [dostęp: 25.07.2022].
- Barmore W., Bajwa T., Burns B.: Biochemistry, Clotting Factors [dostęp: 25.07.2022].
- Nesbitt W. S., Giuliano S., Kulkarni S., Dopheide S. M., Harper I. S., Jackson S. P.: Intercellular calcium communication regulates platelet aggregation and thrombus growth [dostęp: 25.07.2022].
- Palta S., Saroa R., Palta A.: Overview of the coagulation system [dostęp: 25.07.2022].
- Gołębiewska E. M., Poole A. W.: Platelet secretion: From haemostasis to wound healing and beyond [dostęp: 25.07.2022].
- Jardín I., López J. J., Pariente J. A., Salido G. M., Rosado J. A.: Intracellular Calcium Release from Human Platelets: Different Messengers for Multiple Stores [dostęp: 25.07.2022].
- Singh S., Dodt J., Volkers P., Hethershaw E., Philippou H., Ivaskevicius V., Imhof D., Oldenburg J., Biswas A.: Structure functional insights into calcium binding during the activation of coagulation factor XIII A [dostęp: 25.07.2022].
- Klimuszko E., Orywal K., Sierpińska T., Sidun J., Gołębiewska M.: Evaluation of calcium and magnesium contents in tooth enamel without any pathological changes: in vitro preliminary study [dostęp: 25.07.2022].
- Power M. L., Heaney R. P., Kalkwarf H. J., Pitkin R. M., Repke J. T., Tsang R. C., Schulkin J.: The role of calcium in health and disease [dostęp: 25.07.2022].
- Villa-Etchegoyen C., Lombarte M., Matamoros N., Belizán J. M., Cormick G.: Mechanisms Involved in the Relationship between Low Calcium Intake and High Blood Pressure [dostęp: 25.07.2022].
- Fountain J. H., Lappin S. L.: Physiology, Renin Angiotensin System [dostęp: 25.07.2022].
- Marks A. R.: Calcium and the heart: a question of life and death [dostęp: 25.07.2022].
- Eisner D. A., Caldwell J. L., Kistamás K., Trafford A. W.: Calcium and Excitation-Contraction Coupling in the Heart [dostęp: 25.07.2022].
- Pagel P. S., Freed J. K.: Chapter 4 – Cardiac Psychology, Kaplan’s Essentials of Cardiac Anesthesia (Second Edition) [dostęp: 25.07.2022].
- Sun Y.-B., Lou F., Irving M.: Calcium- and myosin-dependent changes in troponin structure during activation of heart muscle [dostęp: 25.07.2022].
- Pollock J. D., Makaryus A. N.: Physiology, Cardiac Cycle [dostęp: 25.07.2022].
- Sutanto H., Heijman J.: The Role of Calcium in the Human Heart: With Great Power Comes Great Responsibility [dostęp: 25.07.2022].
- Fearnley C. J., Roderick H. L., Bootman M. D.: Calcium Signaling in Cardiac Myocytes [dostęp: 25.07.2022].
- Vig M., Kinet J.-P.: Calcium signaling in immune cells [dostęp: 25.07.2022].
- Diamantstein T., Odenwald M. V.: Control of the Immune Response in vitro by Calcium Ions [dostęp: 25.07.2022].
- Oh-hora M., Rao A.: Calcium signaling in lymphocytes [dostęp: 25.07.2022].
- Krystel-Whittemore M., Dileepan K. N., Wood J. G.: Mast Cell: A Multi-Functional Master Cell [dostęp: 25.07.2022].
- Cano R. L. E., Lopera H. D. E.: Introduction to T and B lymphocytes, Autoimmunity: From Bench to Bedside [dostęp: 25.07.2022].
- Dustin M. L.: The immunological synapse [dostęp: 25.07.2022].
- Prakriya M.: Calcium and cel function [dostep: 25.07.2022].
- Clapham D. E.: Calcium Signaling [dostęp: 25.07.2022].
- Munaron L., Antoniotti S., Lovisolo D.: Intracellular calcium signals and control of cell proliferation: how many mechanisms? [dostęp: 25.07.2022].
- Cooper G. M.: The Cell: A Molecular Approach, 2nd edition [dostęp: 25.07.2022].
- Tombes R. M., Borisy G. G.: The Essential Roles of Calcium During Mitosis [dostęp: 25.07.2022].
- Machaca K.: Ca2+ signaling, genes and the cell cycle [dostęp: 25.07.2022].
- Blagosklonny M. V., Pardee A. B.: The Restriction Point of the Cell Cycle [dostęp: 25.07.2022].
- Shi J., Du X.: Identification, characterization and expression analysis of calmodulin and calmodulin-like proteins in Solanum pennellii [dostęp: 25.07.2022].
- Dobi A., Agoston D. V.: Submillimolar levels of calcium regulates DNA structure at the dinucleotide repeat (TG/AC)n [dostęp: 25.07.2022].
- Ralec C., Henry E., Lemor M., Killelea T., Henneke G.: Calcium-driven DNA synthesis by a high-fidelity DNA polymerase [dostęp: 25.07.2022].
- Orrenius S., Zhivotovsky B., Nicotera P.: Regulation of cell death: the calcium–apoptosis link [dostęp: 25.07.2022].
- Kuo I. Y., Ehrlich B. E.: Signaling in Muscle Contraction [dostęp: 25.07.2022].
- Wojton D., Rędowicz M. J.: Plastyczność mięśni szkieletowych: od miogenezy po regenerację [dostęp: 25.07.2022].
- Reid I. R., Birstow S. M., Bolland M. J.: Calcium and Cardiovascular Disease [dostęp: 25.07.2022].
- Florencio-Silva R., Silva Sasso G. R. d., Sasso-Cerri E., Simões M. J., Cerri P. S.: Biology of Bone Tissue: Structure, Function, and Factors That Influence Bone Cells [dostęp: 25.07.2022].
- Balk E. M., Adam G. P., Langberg V. N., Earley A., Clark P., Ebeling P. R., Mithal A., Rizzoli R., Zerbini C. A. F., Pierroz D. D., Dawson-Hughes B.: Global dietary calcium intake among adults: a systematic review [dostęp: 25.07.2022].